Содержание
- Когда назначается исследование и для чего используется?
- Причины возникновения дисбактериоза
- Как правильно подготовиться к анализу
- Анализ кала на дисбактериоз с определением чувствительности
- Определение чувствительности к фагам
- Расшифровка результатов
- Чувствительность к бактериофагам (моча, отделяемое половых органов, кал, зев, нос, пазухи, мокрота, гной, пункционная жидкость, желчь, кровь, отделяемое уха, грудное молоко)
- Показания к анализу кала
- Подготовка к сдаче анализа
- Нормы и расшифровка результата
- Посев кала на микрофлору с определением чувствительности возбудителя к антибактериальным препаратам
- Исследование кала на дисбактериоз количественное с подтитровкой к антибиотикам и фагам
- Определение чувствительности к бактериофагам
- Биопроба. Определение чувствительности к фагам
- Антибиотики
- Чувствительность к бактериофагам
- Дисбактериоз кишечника с определением чувствительности к бактериофагам
Когда назначается исследование и для чего используется?
Данный анализ входит в спектр исследований, необходимых для диагностики синдрома избыточного бактериального роста или дисбиоза. Гастроэнтерологи рекомендуют не ограничиваться посевом кала на дисбактериоз. Исследование позволяет определить качественный состав флоры кишечника. Можно даже обнаружить их количество при наличии современных тест-систем.
Самое важное, для чего и выполняется этот анализ, связано с возможным лечением.
Бактериофаготерапия может стать дополнением к уже назначенным антибактериальным средствам, либо альтернативным методом лечения при непереносимости или неэффективности последних. А для выбора бактериофага необходимо убедиться, что к нему чувствительна патогенная флора, на которую решено воздействовать.
Именно для этого проводится описываемый анализ. Еще одно важное применение для исследования на чувствительность к бактериофагам сводится к контролю над проводимым лечением. Анализ на чувствительность к бактериофагам используется не только в целях диагностики кишечного дисбиоза.

Обследование проводится в следующих областях медицины:
| Раздел медицины | Практическое применение |
| Общая хирургия | Лечение остеомиелита, ожогов, рожистого воспаления. |
| Урология | Диагностика циститов, цистопиелонефритов. |
| Оториноларингология | Диагностика тонзиллитов, отитов, синуситов, их лечение при затяжном течении и неэффективности антибиотиков. |
| Гинекология | Идентификация возбудителей при воспалительных заболеваниях женских половых органов. |
| Дерматология | Лечение карбункулов, фурункулов, флегмонозного воспаления. |
Причины возникновения дисбактериоза
Каждый орган, каждая часть тела человека представляет собой некий биоценоз. Иными словами, это совокупность существующих там бактерий. В желудочно-кишечном тракте обитают одни микроорганизмы, в то же время мочеполовую системы заселяют другие, а на коже обнаруживают третьи.
При некоторых ситуациях их количество и соотношение меняется. Иногда это становится причиной заселения патологическими бактериями. Эта ситуация и составляет суть дисбактериоза.
Причинных и предрасполагающих факторов развития этого патологического состояния существует много. В первую очередь, исключаются органические причины. Например, после операций. Очень часто баланс микрофлоры нарушается после удаления кишки по причине опухоли или кишечной непроходимости.
Среди операций, которые могут привести к дисбиозу, рассматривают ваготомию (для лечения язвы желудка), резекцию части желудка или двенадцатиперстной кишки. Формирование послеоперационных свищей предрасполагает к развитию дисбиоза кишечника.

Анализ на чувствительность к бактериофагам применяется для выявления дисбактериоза.
Следующая группа заболеваний связана с хроническим воспалением слизистой оболочки. Где бы ни был локализован этот патологический процесс, его обязательно будет сопровождать нарушение нормального соотношения полезных и условно-патогенных бактерий. Сюда относят илеиты, еюниты, дуодениты, колиты, а также циститы, уретриты, кольпиты, вагиниты, простатиты.
Нарушения моторной функции вызывают застой кишечного содержимого и тем самым создают благоприятные условия для заселения патогенной и условно-патогенной флоры. Для последних условия становятся настолько благоприятными, что они реализуют свои патогенные свойства и вызывают проявления дисбактериоза.
Эта ситуация возможна при сахарном диабете, когда формируется гастростаз в результате формирования автономной диабетической нейропатии как осложнения.
Ухудшение всасывания в результате нарушения функции поджелудочной железы или глистной инвазии отражается на работе кишечника в целом. Поэтому это следующий фактор риска развития дисбактериоза.
Дисбактериоз следует подозревать и исследовать при длительном употреблении антибиотиков. Это же касается пациентов, которые находятся на химотерапии по поводу онкологических заболеваний. Сюда относят и цитостатики, назначаемые при системных заболеваниях, ревматоидном артрите, гломерулонефритах.
Дисбиоз наблюдается при выраженном снижении иммунитета. Поэтому его исключают при ВИЧ-инфекции. У детей с первичным иммунодефицитом тоже необходимо исследовать кал на дисбактериоз.
Как правильно подготовиться к анализу
Любое обследование, в котором в качестве биологического материала выступает кал, требует подготовки. Она позволит предотвратить искажение результатов и появление ложноположительных или ложно-отрицательных интерпретаций.

В первую очередь, акцент ставится на диете. Исключаются мясные продукты. Лучше, если продукты из рыбы также не будут использоваться в пищу хотя бы за 3 дня до планируемого обследования. Не следует употреблять блюда из свеклы, которые красят биологический материал. Алкогольсодержащие напитки также рекомендовано исключить из рациона.
На лекарственные средства также лучше обратить внимание. Особенно это касается антибактериальных препаратов. Они убивают микрофлору, тем самым искажая результаты исследования.
Акт дефекации должен быть максимально естественным и произвольным. Следует стараться избегать приема слабительных препаратов. Перед актом опорожнения кишечника необходимо провести тщательную гигиену области промежности. Для этого промывают анус и перианальную область промыть теплой мыльной водой.
Анализ кала на дисбактериоз с определением чувствительности
Исследование применяется для диагностики дисбиотических нарушений. Назначает его доктор (терапевт, врач общей практики, педиатр или гастроэнтеролог). Анализ кала на дисбактериоз представляет собой посев кала на специальные питательные среды, в том числе, на чувствительность к бактериофагам.
При наличии в кишечном содержимом того или иного микроорганизма на чашках Петри в лаборатории вырастет целая колония бактерий. По их росту, интенсивности и количеству бактерий определяется дисбиоз и его степени тяжести.
Подготовка тары
В качестве посуды можно использовать маленькие стеклянные баночки из-под консервов, аджики, майонезе, джема. Но важно правильно обработать их. Лучше, если предварительно их промыть с любым моющим средством, а затем, смыв антисептик, прокипятить банку. Крышка подвергается такой же обработке.

В настоящее время большинство лабораторий предъявляет обязательные требования к таре для сдачи кала. Это должны быть одноразовые контейнеры. Их приобретение значительно упрощает задачу.
Сбор материала
Для того, чтобы не пытаться опорожнить кишечник в маленькую тару, лучше воспользоваться пищевой пленкой. Ее следует натянуть над унитазом. Затем после дефекации ложечкой, которая прикреплена к внутренней поверхности крышечки контейнера, нужно положить в него не более 10 г кала.
Сроки и условия хранения кала
Самый лучший вариант, при котором возможно максимально четко и полно сохранить весь микробиологический состав фекалий, это доставка анализа к лаборатории в течение 3 ч. Но это не всегда возможно, так как позывы к дефекации — не всегда контролируемый процесс. Особенно много проблем у пожилых пациентов, склонных к запорам.
Рекомендуется хранение биологического материала в условиях холодильника. Это ни в коем случае не должна быть морозильная камера.
Как правило, температурный оптимум для хранения фекалий составляет от 4 до 9 градусов. Поэтому такие условия можно найти лишь на средней полке. Боковые полочки также не подходят. В условиях комнатной температуры кал должен находиться максимум 15-20 мин. А в холодильнике при оптимальных температурных условиях до 8 ч.
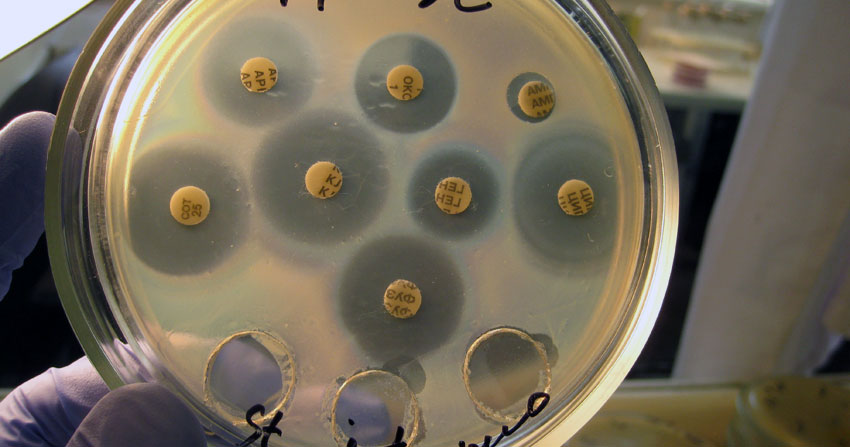
Определение чувствительности к фагам
Анализ на чувствительность к бактериофагам важен как в диагностическом, так и в лечебном плане. Обычно он выполняется после микробиологического исследования или посева кала на флору. После того, как выделена чистая патогенная культура, проводится исследование на чувствительность ее к существующим в арсенале бактериофагам.
Как определяют чувствительность к фагам
Используется также микробиологический метод. По тому, насколько быстро и полно наступил лизис бактерий в выросшей колонии, оценивается чувствительность к бактериофагу. Буквой S отображается, что микробы чувствительны к вирусным частицам, а буква R говорит о наличии резистентности.

Для максимально информативного результата обследования необходимо использовать специальные твердые и полужидкие среды. В качестве бактериофагов применяют один моновалентный фаг, который направлен на конкретную выделенную ранее колонию бактерий.
Второй и третий фаг нужны для контроля. По своим свойствам они поливалентные, то есть неспецифические, и действуют на все виды бактериальных клеток.
Расшифровка результатов
Анализ на чувствительность к бактериофагам должен быть правильно интерпретирован. Для этого обращаются к терапевту или гастроэнтерологу. Иногда может понадобиться помощь инфекциониста.
Выделяют нормальные, условно-патогенные и патогенные бактерии. Нужно стремиться не допускать снижения количества первых, а также повышения на этом фоне количества бактерий 2-й и 3-й групп.
Нормальные бактерии
Это, в первую очередь, представители бифидобактерий. Их норма у детей — 10 000 000 000 — 100 000 000 000 КОЕ/г. Для взрослых их число несколько меньше — от 1 000 000 000 до 10 000 000 000 КОЕ/г. Заметное снижение количества этих полезных для кишечника бактерий приводит к дисбактериозу.

Вторая важная группа — лактобактерии. Для взрослых норма составляет 10 000 000 — 100 000 000 КОЕ/г. При заболеваниях кишечника и других состояниях их количество падает. Тогда реализуются все условия, чтобы выросло количество условно-патогенных микроорганизмов, и они реализовали свои патогенные свойства.
Условно-патогенные бактерии
Важно оценить не только количество выделенных микроорганизмов, но и состояние нормальной флоры. Если с ней есть проблемы (дефицит бифидо- и лактобактерий), следует говорить о дисбактериозе. Особенно это касается ситуаций, когда есть клинические признаки синдрома избыточного роста бактерий в кишечнике.

К условно-патогенным микроорганизмам относят:
- Клебсиеллу;
- Цитробактер;
- Протей;
- Энтеробактер;
- Хафнию.
Бактериофаги отлично дополнят анализ (посев) на микрофлору при подозрении на дисбактериоз.
Патогенные бактерии
В случае обнаружения даже минимального количества колоний представителей этой группы бактерий, следует активно лечить дисбактериоз. К ним относят Стафилококк, а также дрожжеподобные Кандиды, а также Энтерококки.
Важно определять их количество для дальнейшего мониторинга эффективности лечения. Бактериофаги необходимы для определения чувствительности к ним. Ведь при неэффективности к антибиотикам именно к фаготерапии придется обратиться к врачу.
Несмотря на то, что невозможно полностью предотвратить передачу патогенов, для минимизации вероятности инфекционных заболеваний, нужно поддерживать правильную гигиену.
Медицинский анализ, направленный на определение чувствительности или резистентности к определенным бактериофагам, служит хорошим подспорьем при наличии подозрений на дисбактериоз. Это очень перспективно в диагностическом плане, а также создает перспективу для развития отрасли фаготерапии как альтернативы антибиотикам.
>Видео о бактериофагах
Фильм о бактериофагах:
Чувствительность к бактериофагам (моча, отделяемое половых органов, кал, зев, нос, пазухи, мокрота, гной, пункционная жидкость, желчь, кровь, отделяемое уха, грудное молоко)
Анализ на чувствительность к бактериофагам позволяет определить количественный и качественный состав микрофлоры изучаемого биоматериала. С помощью исследования удается выявить условно-патогенные и патогенные микроорганизмы в высоком титре, а также определить их устойчивость к антибактериальным лекарственным препаратам.
Анализ назначают для:
- выявления возбудителя инфекционного заболевания,
- подбора оптимальной антимикробной терапии,
- оценки эффективности проводимой терапии.
Исследование проводится методом бактериологического посева на флору с определением чувствительности к бактериофагам. Для изучения могут быть использованы различные биоматериалы:
- разовая порция мочи,
- отделяемое половых органов,
- кал,
- мазок из ротоглотки или носоглотки,
- гной,
- желчь,
- кровь,
- мокрота,
- пункционная жидкость,
- мазок из носа,
- грудное молоко,
- отделяемое уха.
В зависимости от типа исследуемого материала анализ на чувствительность к бактериофагам требует специальной подготовки. За 8-12 часов до забора мокроты необходимо употребить большой объем воды. В течение 48 часов до сдачи мочи следует исключить прием мочегонных препаратов. Женщинам рекомендовано сдавать урогенитальный мочу или мазок до начала менструации или через 2 дня после ее окончания. Мужчинам перед сдачей этого материала нельзя мочиться в течение 3 часов.
Результатом анализа на чувствительность к бактериофагам являются данные, описывающие качественный и количественный состав микрофлоры. При обнаружении условно-патогенных микроорганизмов определяется их чувствительность. Поставить точный диагноз по результатам обследования и разработать эффективный курс лечения может только врач.
Сдать анализы удобно в нашей клинике в любое время. Для получения дополнительной информации об исследовании обращайтесь по телефону. Уточняйте стоимость анализа на сайте в разделе «Наши цены».
Показания к анализу кала
Данное обследование назначается с целью:
- определения возбудителей некоторых видов заболеваний;
- для определения наиболее эффективных для лечения препаратов;
- для оценки правильности проводимого лечения.
Анализ кала на бактериофаги проводится чаще всего для подбора препаратов, способных уничтожить болезнетворные микроорганизмы, поселившиеся в кишечнике. Бактериофаги в отличие от антибиотиков являются живыми микроорганизмами. Они действуют узконаправленно на определенные виды бактерий. Потребность в таком исследовании возникает:
- после длительного приёма антибиотиков, противовирусных препаратов;
- после прохождения курса химиотерапии;
- после длительного приема гормональных препаратов;
- при резком снижении иммунитета;
- у пожилых пациентов в связи с изменением флоры кишечника под влиянием возрастных изменений, таких как увеличение бактерий усиливающих синтез холестерина и увеличение бактерий, относящихся к гемолитической флоры;
- при обследовании пациентов с хроническим панкреатитом, хроническим алкоголизмом и другими состояниями, сопровождающимися мальабсорбцией.
Исследование кала проводится в том случае, если пациент обращается с жалобами:
- на изменение консистенции кала;
- на изменение цвета и запаха;
- при появлении посторонних примесей в виде слизи и частиц непереваренной пищи.
Чаще всего анализ назначается лечащим врачом.
Подготовка к сдаче анализа
Для проведения исследования рекомендуется соблюдать следующие правила:
- Не требуется большое количество кала, но его должно быть не меньше одного грамма.
- Контейнер для сбора материала должен быть обязательно стерильным и сухим. Для этих целей может быть использована стерильная пробирка или одноразовый контейнер, который можно приобрести в аптеке.
- Кал необходимо собирать после полного освобождения мочевого пузыря и проведения гигиенических процедур. Это делается для того, чтобы извне в исследуемый материал не попали посторонние бактерии.
- Полученный материал нельзя хранить в холодильнике.
- Кал должен быть получен непосредственно перед визитом в лабораторию.
- Материал для обследования должен быть предоставлен в течение одного — двух часов.
На контейнере указываются данные пациента, а также перечень препаратов которые принимались перед началом дисбактериоза.
На конечный результат может повлиять прием лекарственных препаратов, особенно антибактериальных. Также на полученный результат сильно влияет время доставки материала. На итог исследования влияют микроорганизмы, проникающие в материал извне.
Нормы и расшифровка результата
Из лаборатории врачу поступают данные, в которых указывается перечень микроорганизмов, выявленных в ходе обследования и их количество в определенном объеме. Так как значения большие у каждого значения имеется степень. В зависимости от количества микробов выделяют следующие уровни:
- нормальное количество;
- сниженное количество;
- повышенное количество.
Результат сравнивается с приложенными к результату анализа референтными значениями.
Фаги являются организмами, которые паразитируют на бактериях и тем самым их уничтожают. Под действием препаратов из фагов:
- Рост колонии прекращается. Это означает, что данная флора подавляется этим типом фага и бактерии к нему чувствительны.
- Если рост замедляется, то говорят о том, что флора условно чувствительна к данному фагу.
- Если рост колонии не прекращается, даже при достижении максимальной терапевтической дозы, то микроорганизмы не чувствительны к фагам.
Полученные данные помогают доктору подобрать правильное лечение, поэтому расшифровку лучше доверить врачу.
Посев кала на микрофлору с определением чувствительности возбудителя к антибактериальным препаратам
Анализ на микрофлору (бактериологический посев) – микробиологическое исследование, позволяющее определить качественный и количественный состав микрофлоры исследуемого биоматериала, в том числе выявить условно-патогенные микроорганизмы и патогенные микроорганизмы, определить их чувствительность к препаратам.
Условно-патогенная флора – это микроорганизмы, которые присутствуют у человека в умеренных количествах.
Однако при определенных условиях их количество увеличивается и превышает допустимую норму, что приводит к соответствующим заболеваниям.
К наиболее распространенным представителям условно-патогенной флоры кишечника относятся:
-золотистый стафилококк (S. aureus)
-клебсиеллы (Klebsiella), эшерихии (Escherichia)
-энтеробактер (Enterobacter)
-цитробактер (Citrobacter)
-ацинетобактер (Acinetobacter)
-протей (Proteus)
-клостридии (Clostridia)
-серрации (Serratia)
-псевдомонады (Pseudomonas)
-дрожжеподобные грибы (Candida и др.) и другие возбудители.
Эти микроорганизмы могут вызывать инфекционное поражение желудочно-кишечного тракта с развитием гастроэнтерита, энтерита и энтероколита.
При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре, не превышающем референсных интервалов, не определяется чувствительность к антибиотикам и бактериофагам, так как это не имеет диагностического значения (Определение расширенного спектра антибиотико- и фагочувствительности выполняется согласно методическим рекомендациям МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам»
Исследование кала на дисбактериоз количественное с подтитровкой к антибиотикам и фагам
| Артикул | Наименование услуг | Цена, руб. | Доступность экспресс | Ед. измер. | Материалы | Заказать |
|---|---|---|---|---|---|---|
| 403 | Исследование кала на дисбактериоз количественное с подтитровкой к антибиотикам и фагам | 1 200 p (Время исполнения до 14 дней) | 1 исслед. | F C |
Нарушение экологии микроорганизмов желудочно-кишечного тракта носит название «дисбактериоз кишечника», который определен как клиниколабораторный синдром, возникающий при целом ряде заболеваний и клинических ситуаций, характеризующийся изменением качественного и/или количественного состава нормофлоры определенного биотопа, а также траслокацией различных ее представителей в несвойственные биотопы, метаболическими и иммунными нарушениями.
Нарушения нормальной микрофлоры кишечника характеризуются исчезновением или снижением количества облигатных ее представителей, и увеличением популяционного уровня условно – патогенных микрорганизмов, отсутствующих или встречающихся в ничтожных количествах в норме. В итоге при доминировании условно – патогенных представителей дефицит облигатных симбионтов уже не в состоянии обеспечивать защитные и физиологические функции нормофлоры, осуществляемые в условиях нормобиоценоза кишечника.
Дисбактериозы могут возникать при воздействии самых различных факторов экзогенной и эндогенной природы, включая:
Климато – географические и экологические условия, характер и качество питания, санитарно-гигиенические условия;
Ослабление резистентности макроорганизма, вызванное инфекционными и соматическими болезнями, медикаментозной, антибактериальной, гормональной терапией, а также общим вариабельным имунодефицитным состоянием;
Стрессовые ситуации, ранения, травмы, оперативные вмешательства и другие повреждения кожных покровов и слизистых оболочек нарушением тканевой микроциркуляции.
Показаниями к проведению исследования фекалий являются: длительно протекающие кишечные расстройства, затянувшийся период реконвалесценции после острых кишечных заболеваний, обострения хронических заболеваний желудочно-кишечного тракта (колиты, холециститы, язвенная болезнь и др.), наличие системной воспалительной реакции и бактеримии без выраженного очага воспаления, аллергические заболевания, хроническая сердечно — сосудистая патология, наличие гнойно – воспалительных очагов, трудно поддающихся лечению (пиелит, холецистит, язвенный колит, энтероколит.
В настоящее время подвергается оценке в основном просветная микрофлора, пристеночная микрофлора до сих пор остается малодоступной для изучения из-за сложности получения материала для исследования. Наиболее легко собирать фекалии для определения микрофлоры в прямой кишке. Поэтому данные, полученные при анализе фекалий, являются косвенным показателем, частично отражающим степень дисбиотических изменений.
Взятие
В течение 1 – 3 дней до забора материала для исследования исключают антимикробные лекарственные препараты. От момента последнего принятия пищи до взятия материала должно пройти не менее 8 – 10 часов. Проба на дисбактериоз предоставляется в отдельном контейнере и не может быть использована для каких-либо других анализов еще ( в том числе общего анализа) Пробу фекалий собирают в стерильный герметичный контейнер с плотно закрывающейся крышкой без консерванта. Вес пробы должен быть около 2 г. (размером не менее грецкого ореха). Пробу для исследования берут из средней или последней порции фекалий. При наличии в фекалиях патологических примесей – слизь, кровь, хлопья, гной – следует включать их в отбираемую пробу. Материал доставляется в лабораторию не позднее чем через 2 часа после его взятия. Смывы из прямой кишки не подходят для данного исследования!!!
Значение
Бактериологическое исследование связано с количественным определением индигенных и транзиторных микроорганизмов: бифидобактерий, лактобактерий, эшерихий, условно-патогенных энтеробактерий, стафилококков, энтерококков, клостридий, псевдомонад, грибов рода Candida. При выделении патогенных бактерий, либо увеличении количества условно патогенных энтеробактерий определяется чувствительность к антибактериальным препаратам и бактериофагам: Оксациллин 10 мкг, Цефотаксим (клафоран, тарцефоксим) 30мкг, Гентамицин (герамицин, генцин) 10мкг, Доксициклин (вибрамицин, доксилан, довицин)30мкг, Левомицетин(хлорамфеникол) 30мкг, Линкомицин (линкоцин, нелорен) 15мкг, Имипенем (тиенам, примаксин)10мкг, Меропенем (меронем) 10мкг, Офлоксацин (таривид, заноцин) 10мкг, Цефтазидим (фортум, тазицеф) 30мкг, Ципрофлоксацин (ципробай, ципролет) 5 мкг, Ампициллин (ампицид, амплитал, росциллин) 10мкг, Амоксициллин (кламоксил, амоксил, флемоксин) 20мкг, Амоксициллин – клавунат (синулокс, амоксиклав, аугментин)20/10мкг, Рифампицин (бенемицин, рифадин, тубоцин) 5мкг, Цефуроксим (аксетин, кетоцеф)30мкг, Цефазолин (кефзол, анцеф, цефаприм, прозолин) 30мкг, Цефалексин (оспексин, пролексин, цефаклен) 30мкг, Левофлоксацин (таваник) 5 мкг, Цефтриаксон 30мкг, Энрофлоксацин (байтрил, энрофлон, карифлокс, энроксил, энрофлокс, энробиофлокс) 10мкг Список антимикотических препаратов: Флюконазол, Кетоконазол, Интраконазол, Нистатин, Амфотерицин, Клотримазол. При трактовке результатов следует учитывать тот факт, что кишечная микрофлора животного – это весьма лабильная система, подверженная колебаниям в зависимости от многих эндогенных и экзогенных факторов. Поэтому, чтобы отличить так называемые временные вариации состава микрофлоры от дисбактериоза, необходимо проведение 2 -3 кратных исследований с интервалом 1-2дня. При оформлении результатов исследований отмечают качественный, количественный состав выделенных микроорганизмов, наличие или отсутствие в посеве фекалий патогенных энтеробактерий – сальмонелл, энтеропатогенных гемолитических кишечных палочек, дается описание состава кишечной микрофлоры. Конечной целью исследования является выявление возможных дисбиотических изменений микрофлоры кишечника, но при этом вопрос о постановке диагноза и, соответственно, определении степени дисбактериоза не является прерогативой бактериолога. Бактериологическое исследование является главным звеном в постановке клинического диагноза, однако окончательная интерпретация результата должна оставаться за клиницистом, который суммирует данные собранного анамнеза, клинического осмотра, количественных и качественных изменений микробного фона в динамике с учетом оценки иммунного статуса обследуемого.
Определение чувствительности к бактериофагам
Общая информация
Определение чувствительности к бактериофагам представляет собой микробиологическое исследование, которое направленно на обнаружение бактериофагов, к которым обладают чувствительностью патогенные бактериальные клетки. Бактериофаги, производятся фармакологической промышленностью в различных формах, жидких, таблетированных. Показанию к проведению этого лабораторного исследования является заболевания кишечника. Данный тест считается одним из дополнительных методов терапии кишечных инфекций, энтероколитов, гнойных ран, циститов и некоторых других инфекционных заболеваний.
Бактериофаги – это вирусы, которые избирательно поражают бактериальные клетки. При внедрении в бактериальную клетку бактериофаг вызывает лизис бактерий. Иными словами, бактериофаги – это специфическая живая лекарственная форма способная уничтожать определенные виды бактерий. В медицинской практике бактериофаги применяются в качестве дополнительного метода терапии некоторых инфекционных заболеваний вместе с антибиотиками.
Антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в бактериальную клетку с последующим его размножением и лизисом зараженной клетки. Вышедшие во внешнюю среду в результате лизиса бактериальной клетки бактериофагов способны повторно инфицировать и лизировать другие бактериальные клетки, так они действуют до полного уничтожения патогенных бактерий в воспалительном очаге.
В результате интенсивного развития химической промышленности, созданием и внедрением новых антибиотиков и антисептиков интерес к бактериофагам значительно снизился.
В наше время на фоне повышения резистентности к антибиотикам основных возбудителей инфекционных осложнений у пациентов хирургического и травматолого-ортопедического профиля, возникновением новых полирезистентных штаммов патогенных бактерий, поиск и создание новых высокоэффективных лекарственных средств, которые бы обладали высокой антибактериальной активностью продолжается.
В настоящее время имеются сведенья о использовании бактериофагов в терапии инфекционных заболеваний и осложнений различного генеза, а также различных хирургических инфекций.
Использование в лечении инфекционных заболеваний бактериофагов обладает рядом преимуществ:
бактериофаги демонстрируют высокую специфичность в терапии инфекционных заболеваний;
они не ингибируют развитие нормальной микрофлоры;
они не вызывают дисбаланс внутренней среды организма;
фаготерапия является этиотропной и обладает высокой специфичностью;
применение бактериофагов не имеют противопоказаний, что позволяет их использовать в терапии беременных и кормящих женщин, а также детей различного возраста, включая недоношенных;
бактериофаги могут использоваться не только в терапевтических, но и профилактических целях;
они не вызывают развития резистентности микроорганизмов;
они оказывают стимулирующего влияния на гуморальное и клеточное звенья иммунитета;
они не оказывают токсического воздействия, не провоцируют развитие аллергических реакций и не обладают тератогенным эффектом;
они демонстрируют высокую эффективность в монотерапии, но также могут применяться совместно с другими лекарственными средствами, например, антибиотиками и пробиотиками.
При использовании бактериофагов необходимо учитывать, что при отсутствии фагочувствительности к ним у выделенного микробного агента, возбудителя инфекционно-воспалительного процесса, это может способствовать усилению или развитию антибиотикорезистентности у возбудителя. Кроме этого, имеется риск развития реакции обострения Яриша–Гексгеймера, которая возникает на фоне высвобождения значительного количества токсинов, в случае массивной гибели микробов при внутривенном введении бактериофага.
Данное исследование направлено на определение чувствительность возбудителей инфекционных осложнений у пациентов после травм и оперативных вмешательств на опорно-двигательной системе к препаратам бактериофагов.
Показания
Определение чувствительности к бактериофагам представляет собой исследование, которое применяется при обнаружении лекарственно-устойчивых к широкому спектру антибактериальных препаратов форм патогенных и условно-патогенных бактерий.
Полученные результаты
По спектру действия различают моновалентные бактериофаги, лизирующие бактерии одного вида, и поливалентные – вызывающие лизинг бактерий нескольких видов.
В результатах определения чувствительности к бактериофагам обозначение S указывает на чувствительность микроорганизма к данному препарату, R – на резистентность.
Врач-консультант
Данное исследование может быть назначено инфекционистом, хирургом, врачом общей практики, травматологом.
Биопроба. Определение чувствительности к фагам
Определение чувствительности к фагам. Тестируемые культуры должны быть в S-форме. Суспензию бруцелл готовят как для РА и засевают сплошным газоном на плотную питательную среду. Тв-фаг стандартизуют в рутинном тесте разведения (RTD) и для титрования берут RTD и 10000xRTD. Также используют фаги репрезентативных групп 1-5 Corbell и Thomas. Отдельные капли фага (~0,25 мкл) наносят на поверхность засеянного агара, инкубируют при 37° С, учет проводят через 24 часа и далее с этим же интервалом.
Определение уреазной активности. Рекомендуется проводить на среде Кристенсен с инкубацией при 37°С, Считывая результат через 0,5 -1 -2 -3 -4 -5 и 24 часа. На среду засевают одну бактериологическую петлю испытуемой культуры. Результат считается отрицательным, если уреазная активность не проявляется в течение 24 часов. Культуры В. suis, В. canis и В. neotomae изменяют среду В течение 15 минут. Большинство штаммов В. abortus, B. melitensis дают позитивную реакцию в интервале 1-24 часа инкубации. Культуры В. ovis — уреазонегативные.
Оксидативный метаболизм. Испытуемые культуры выращивают на сывороточно-декстрозном агаре 48 часов, смывают фосфатным буфером Соренсена (рН 7,0), трехкратно отмывают центрифугированием и стандартизируют до концентрации, эквивалентной 0,9 MrN/мл по Кьельдалю. Измерение поглощения кислорода проводят объемным респирометром с определением константы Варбурга. Поглощение кислорода выражают в виде микролитров на миллиграмм клеточного азота за час (QО2N).
Определение образования сероводорода. Испытуемую культуру бруцелл выращивают на скошенном печеночном агаре в пробирках с бумажкой, пропитанной насыщенным водным раствором уксуснокислого свинца. Результаты учитывают через каждые два дня в течение 6 дней.
Таблица 68 — Дифференциация видов и биоваров рода Brucella
| Признаки | В. abortus биовары | В. canis | В. melitensis | В. neotomae | В. ovis | В. suis | ||||||||||||||
| Потребность в СО2 | (+) | (+) | (+) | (+) | — | — | — | — | (+) | |||||||||||
| Образование H2S | + | + | + | + | — | (-) | (+) | — | — | — | — | — | + | — | + | — | — | — | ||
| Рост в среде, содержащей | тионин | — | — | + | — | + | + | — | — | — | — | — | — | -1 | + | + | + | + | + | |
| основной фуксин | + | — | + | + | + | + | + | + | (-) | + | + | + | — | (-) | (-) | — | + | (+) | ||
| Агглютинация моноспецифическими сыворотками | А | + | + | + | — | — | + | + | — | — | — | + | + | + | — | — | + | + | + | |
| М | — | — | — | + | + | — | + | + | — | + | — | + | — | — | — | — | — | — | + | |
| R | — | — | — | — | — | — | — | — | — | + | — | — | — | — | + | — | — | — | — |
+ — все штаммы положительные;
(+) — большинство штаммов положительно; (-) — большинство штаммов отрицательно; — — все штаммы отрицательны; 1) концентрация красителя 1:50 000 (масса/объем), для более четкой дифференциации биоваров 3 и 6 тионин вносят в концентрации 1:25 000, при этом биовар 3 растет, а биовар 6 — нет.
У культур бруцелл в S-форме изучают: лизис под действием бруцеллезного фага, окисление ряда аминокислот, углеводов, потребность в СО2, образование H2S, уреазы, рост в средах с тионином, основным фуксином, агглютинацию с моноспецифическими сыворотками против антигенов А, М, R.
Определение потребности культур бруцелл первых генераций в СО2.В эксикатор (другой герметически закрывающийся сосуд) с посевами добавляют через газомер СО2 до содержания 5 -10%, либо в сосуд помещают крышку чашки Петри с 0,35 г Na2CО3 на 1000 мл объема, в эту же крышку в наклонном положении помещают пробирку Флоринского с 0,35 мл НС1, сосуд закрывают и, наклоняя его, выливают кислоту, что обеспечивает накопление необходимого количества СО2 в емкости. Параллельно культивируют посевы в условиях обычной атмосферы. Некоторые биовары В. abortus могут не требовать СО2 уже в первой генерации.
Обычно используют следующие субстраты: а-аланин, а-аспарагин,
а-глутаминовая кислота, а-аргинин, Da-цитруллин, Da-орнитин, а-лизин, аа-apaбиноза, D-галактоза, D-глюкоза, D-рибоза, D-ксилоза, мезо-эритритол. Субстраты готовят в виде 10%-ных (вес/объем) растворов в буфере Соренсена (рН 7,0), стерилизуют фильтрацией, хранят при -20° С. Da-цитруллин стерилизуют при 121°С 15 минут. QО2N объем вычисляют по методу Варбурга с коррекцией на эндогенное поглощение О2.
Определение способности к росту на питательных средах с фуксином и тионином.Используют Альбими-агар или триптозный агар с красителями в концентрации 1:50 000 или 1:25 000. Красители в виде 0,1%-ных растворов кипятят в водяной бане в течение 20 минут и затем добавляют в необходимом количестве к расплавленному стерильному агару. Засеянные культурами Чашки Петри инкубируют при 37° С в атмосфере 5-10% СО2 в течение 4 дней. В качестве контроля на среды высевают эталонные штаммы бруцелл определенных видов. Среды хранят в холодильнике не более 10-15дней. Обесцвеченные среды использовать нельзя.
Испытание культур бруцелл в РА с моноспецифическими сыворотками (М, A, R).Моноспецифические сыворотки получают раздельной иммунизацией кроликов соответствующими эталонными штаммами бруцелл с последующей перекрестной адсорбцией агглютининов этими же штаммами.
Густую суспензию испытуемой культуры бруцелл (~ 2 млрд. мк./мл.), выращенной в течение 48 часов на сывороточно-декстрозном агаре, прогревают при 60° С в течение часа в 0,5%-ном феноло-солевом растворе,
смешивают каплю суспензии и каплю моноспецифической сыворотки. Результат учитывают через минуту. Эти исследования необходимо проводить с параллельным контролем в виде антигенов из эталонных штаммов В. abortus (1-й биотип), В. melitensis (1-й биотип), В. ovis и B.canis.
В определенных ситуациях возникает необходимость дифференциации
вакцинного штамма В. abortus N19 от эпизоотических штаммов этого вида бруцелл. В дополнение для этой цели предлагается исследование способности к росту на агаре, содержащем тионин (2 мг/мл), на агаре с эритритолом (1 мг/мл) и устойчивость к пенициллину при использовании дисков с пенициллином (5 ЕД). Культуры вакцинного штамма
В. abortus N19 не растут на средах с указанными концентрациями тионина и эритритола и чувствительны к пенициллину, в отличие от эпизоотических штаммов.
Используют для обнаружения возбудителя в исследуемом материале и проверки патогенных свойств выделенной культуры. Биопроба является достаточно чувствительным методом выделения бруцелл из материала, особенно если предполагается его контаминация посторонней микрофлорой, что достаточно вероятно при исследовании гениталь-ных выделений, молока, сыра и т.д.
Наиболее восприимчивы к бруцеллезу морские свинки и белые мыши, но первые удобнее, так как у них легче брать кровь для серологических исследований. Морских свинок живой массой 350-400 граммов предварительно исследуют в РА в разведении сыворотки крови 1:5-1:40. Для опыта берут животных, не имеющих бруцеллезных антител. Заражение проводят подкожно со стороны внутренней поверхности бедра. Заражают двух морских свинок. Тканевый материал измельчают в стерильном физиологическом растворе 1:10, удаляют грубые частицы путем центрифугирования (1000 об/мин, 5-7 минут), морской свинке вводят 1 мл над осадочной жидкости. Молоко (20 мл) центрифугируют 10 минут при 1000 об/мин и вводят весь осадок и сливки двум морским свинкам. Содержимое бурс, абсцессов вводят в дозе 1 мл.
У морских свинок исследуют кровь в РА через 15, 25 и 40 дней после заражения в разведениях 1:10-1:80. Положительная РА в разведении 1:10 и более свидетельствует о заражении. Положительно реагирующих животных убивают, регистрируют патологоанатомические изменения в печени, селезенке, лимфатических узлах, исследуют бактериологическими методами.
Антибиотики
Определение чувствительности микроорганизмов к антибиотикам и бактериофагам
Культуральное бактериологическое исследование (посев на питательные среды, бак.посев) позволяет получить непосредственно культуру микроорганизма – возбудителя данной инфекции. Выделив культуру, ее можно во-первых точно идентифицировать (определить вид микроба), а во-вторых определить ее чувствительность к лекарственным препаратам – антибиотикам (антибактериальным препаратам) и бактериофагам.
Этот тест (определение антибиотикочувствительности, «подтитровка антибиотиков» ) имеет важнейшее значение для последующего лечения, т.к. позволяет выбрать препарат, максимально подходящий для лечения конкретного возбудителя. Необходимость такого анализа связана с тем, что даже бактерии одного вида, но выделенные от разных животных (разные штаммы) могут отличаться по спектру чувствительности. Сегодня выпускаются десятки наименований антибиотиков (АБ), относящиеся по своему строению к различным группам. Например, для лечения стафилококка могут применяться препараты как минимум девяти фармакологических групп, каждая из которых включает несколько наименований. Выбрать из них оптимальный для лечения конкретного возбудителя – непростая задача, решить которую невозможно без определения антибиотикочувствительности.
Характерная особенность современных возбудителей – частая встречаемость высокоустойчивых (мультирезистентных) штаммов микроорганизмов. Они проявляют устойчивость к действию различных групп антибиотиков – одной или сразу нескольких. Например, грамотрицательные бактерии семейства Enterobacteriaceae (к ним относятся такие распространенные возбудители как Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa) образуют ферменты БЛРС – беталактамазы расширенного спектра. Эти ферменты нейтрализуют действие бета-лактамных антибиотиков (пенициллинов и цефалоспоринов). У штаммов стафилококков также существует механизм резистентности, маркерным признаком которого является устойчивость к метициллину. МРС – метициллинрезистентные стафилококки – проявляют устойчивость ко всем бета-лактамным антибиотикам. Среди энтерококков растет количество полирезистентных штаммов, устойчивых в том числе и к ванкомицину (препарату выбора).
В ходе бактериологического исследования в компетентных лабораториях у микроорганизмов проводят определение указанных маркеров резистентности, и дают результаты в заключении. Это дает информацию лечащему врачу, антибиотики каких групп будут эффективны, какие будут бесполезны. В лабораторной практике нередки случаи, когда возбудитель устойчив почти ко всем протестированным антибиотикам, за исключением 1-2 препаратов.
Определение чувствительности к антибиотикам обычно проводят диско-диффузионным методом, используя стандартизованные питательные среды и стандартизованные диски с антибиотиками. Используют как минимум два набора антибиотиков – один для грамположительных (Гр+), другой для грамотрицательных (Гр-) микроорганизмов (что соблюдается увы не во всех лабораториях). Также наборы антибиотиков несколько отличаются в зависимости от источника происхождения – например, для культур из мочи обычно ставят дополнительно несколько препаратов-«уросептиков».
Если от животного выделено несколько культур микроорганизмов, чувствительность к АБ определяется индивидуально к каждой из них. Результаты лаборатория выдает по общепринятой градации: «Ч» — культура чувствительна к антибиотику; «П» — промежуточный уровень чувствительности; «У» — культура устойчива.
Также целесообразно определение чувствительности к бактериофагам – препаратам вирусной природы, имеющим ряд преимуществ по сравнению с антибиотиками, хорошо себя зарекомендовавшим в гуманной медицине. Существуют моновалентные и поливалентные бактериофаги. В лабораториях обычно определяют чувствительность к трем бактериофагам – одному моновалентному (специфичному для конкретного возбудителя) и двум поливалентным, включающим комплекс фагов против нескольких видов бактерий. Без лабораторного определения чувствительность возбудителя к бактериофагам практически непредсказуема. Фаг может «работать» очень хорошо, а может быть вообще не активным против данной культуры микроба.
Итак, по результатам лабораторного бактериологического исследования врач получает на руки информацию, необходимую для эффективного лечения конкретной инфекции. Традиционный подход (сначала лечим тем, что есть, потом диагностируем) постепенно уходит из практики. Препараты широкого спектра, на которые привыкли надеяться лечащие врачи, все чаще дают сбои, в силу распространения высокоустойчивых штаммов. Кроме того, лечение животного неспецифическим антибиотиком ведет к тому, что нормальная микрофлора организма сильно страдает, а патогенная флора адаптируется к антибиотикам, приобретает устойчивость, и вылечить такое животное в дальнейшем будет крайне сложно.
Очевидно что в экстренных случаях, при критических состояниях у врача нет времени дожидаться результатов анализов. Однако в остальных случаях потраченное на анализ время окупится гораздо быстрее, чем длительное лечение неэффективным препаратом.
Определение чувствительности грибов к противогрибковым препаратам (антимикотикам) также проводится в некоторых диагностических бак.лабораториях и имеет свои особенности, о чем Вы можете прочитать в соответствующем разделе сайта БакПосев-Вет.Ру.
Чувствительность к бактериофагам
Описание
Микробиологическое обоснование выбора бактериофага.
Бактериофа́ги или фа́ги (от др.-греч. φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. В настоящее время их применяют для лечения бактериальных инфекций, которые не чувствительны к традиционному лечению. Обычно, применение бактериофагов сопровождается большим, чем антибиотики, успехом там, где присутствуют биологические мембраны, покрытые полисахаридами, через которые антибиотики обычно не проникают. В настоящее время терапевтическое применение бактериофагов не получило одобрения на Западе, хотя и применяются фаги для уничтожения бактерий, вызывающих пищевые отравления, таких, как Листерии. В многолетнем опыте в объёме крупного города и сельской местности доказана необычайно высокая лечебная и профилактическая эффективность дизентерийного бактериофага.
Дисбактериоз кишечника с определением чувствительности к бактериофагам
Это микробиологическое исследование, позволяющее выявить качественные и количественные нарушения состава микрофлоры кишечника (дисбактериоз), патогенную флору, а также определить чувствительность обнаруженных патогенных или условно-патогенных микроорганизмов к бактериофагам.
Синонимы русские
Исследование микрофлоры кишечника с определением чувствительности к бактериофагам.
Синонимы английские
Метод исследования
Микробиологический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Кал.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приёма антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить приём слабительных препаратов, введение ректальных свечей, масел, ограничить приём медикаментов, влияющих на перистальтику кишечника (белладонны, пилокарпина и др.) и на окраску кала (железа, висмута, сернокислого бария), в течение 72 часов до сдачи анализа.
Общая информация об исследовании
В состав микрофлоры кишечника входит более 500 видов микроорганизмов. Основную роль в поддержании равновесия кишечной флоры играют бактероиды, бифидобактерии и лактобациллы (облигатная флора), которые препятствуют размножению условно-патогенной флоры. Сопутствующая флора представлена кишечной палочкой, энтерококками, пептококками, фузобактериями и эубактериями. В небольшом количестве могут выявляться актиномицеты, бациллы, цитробактер, клостридии, коринебактерии, энтеробактер, пептострептококки, псевдомонады, стрептококки, стафилококки, вейлонеллы, различные вибрионы, кампилобактер, пропионобактерии, плесневые и дрожжеподобные грибы и др.; часть из них является представителями условно-патогенной флоры.
Кишечная микрофлора выполняет ряд важнейших функций: участвует в пищеварении, усиливает местный иммунитет за счёт стимуляции синтеза секреторного IgA, подавляет патогенную флору, синтезирует витамины группы B и K, а также участвует в контроле двигательной активности кишечника, детоксикации и регуляции его газового состава.
При нарушении качественного и количественного состава микрофлоры кишечника, размножении условно-патогенных микроорганизмов развивается дисбактериоз, а в дальнейшем – метаболические, иммунологические и желудочно-кишечные расстройства. Дисбактериоз сопровождается поражением желудочно-кишечного тракта, гиповитаминозом, различными аллергическими проявлениями и общими симптомами (слабостью, повышенной утомляемостью, нарушениями сна и т. д.).
Факторами, способствующими развитию дисбактериоза, являются нарушения переваривания и всасывания (панкреатит, глютеновая энтеропатия), оперативные вмешательства и нарушения двигательной активности кишечника (запоры, поносы, кишечная непроходимость), приём антибиотиков, глюкокортикостероидов и цитостатиков, иммунологические нарушения.
Для диагностики дисбактериоза используют микробиологическое исследование кала, позволяющее определить качественный и количественный состав нормальной и условно-патогенной флоры кишечника, а также выявить патогенные микроорганизмы, вызывающие дизентерию, сальмонеллёз, эшерихиоз, брюшной тиф. При обнаружении условно-патогенных микроорганизмов в высоком титре или патогенных микроорганизмов определяется их чувствительность к бактериофагам.
Для чего используется исследование?
- Для диагностики антибиотик-ассоциированной диареи.
- Для выявления дисбактериоза кишечника.
- Чтобы установить причины кишечных расстройств.
- Для подбора рациональной антимикробной терапии бактериофагами.
- Чтобы оценить эффективность терапии дисбактериоза кишечника.
Когда назначается исследование?
- При длительных кишечных инфекциях с неустановленным возбудителем.
- После долгого лечения антибиотиками, глюкокортикостероидами, иммунодепрессантами, химиотерапевтическими препаратами.
- При аллергических заболеваниях, которые плохо поддаются лечению (например, атопическом дерматите).
- При планировании операции лицам, предрасположенным к дисбактериозу кишечника.
- При хронических гнойных инфекциях, которые плохо поддаются лечению.
- После воздействия химических веществ или ионизирующей радиации – если есть симптомы дисфункции кишечника.
- При длительном периоде выздоровления после острых кишечных инфекций.
Что означают результаты?
Референсные значения
|
Возраст |
Флора |
Референсные значения |
|
Меньше 1 года |
Бифидофлора |
1010 — 1011 Ед/л |
|
Молочнокислые бактерии |
106 — 108 Ед/л |
|
|
Кишечная палочка с нормальными ферментативными свойствами |
107 — 108 Ед/л |
|
|
Кишечная палочка с гемолизирующими свойствами |
Отрицательно |
|
|
Кишечная палочка со сниженными ферментативными свойствами |
Не более 106 — 107 Ед/л |
|
|
Кишечная палочка, лактозонегативные |
105 Ед/л и менее |
|
|
Клостридии |
Менее 103 Ед/л |
|
|
Энтерококки |
105 — 107 Ед/л |
|
|
Условно-патогенная флора (вся) |
Менее 104 Ед/л |
|
|
Staphylococcus aureus |
Отрицательно |
|
|
Дрожжевые грибы рода Candida |
103 и менее Ед/л |
|
|
Candida albicans |
103 и менее Ед/л |
|
|
Бактерии тифопаротифозной группы |
Отрицательно |
|
|
Бактерии дизентерийной группы |
Отрицательно |
|
|
ЭТ, ЭИ, ЭП эшерихии |
Отрицательно |
|
|
Больше 1 года |
Бифидофлора |
109 — 1010 Ед/л |
|
Молочнокислые бактерии |
107 — 108 Ед/л |
|
|
Кишечная палочка с нормальными ферментативными свойствами |
107 — 108 Ед/л |
|
|
Кишечная палочка с гемолизирующими свойствами |
Отрицательно |
|
|
Кишечная палочка со сниженными ферментативными свойствами |
Не более 107 — 108 Ед/л |
|
|
Кишечная палочка, лактозонегативные |
105 Ед/л и менее |
|
|
Клостридии |
Менее 105 Ед/л |
|
|
Энтерококки |
105 — 108 Ед/л |
|
|
Условно-патогенная флора (вся) |
Менее 104 Ед/л |
|
|
Staphylococcus aureus |
Отрицательно |
|
|
Дрожжевые грибы рода Candida |
104 и менее Ед/л |
|
|
Candida albicans |
104 и менее Ед/л |
|
|
Бактерии тифопаротифозной группы |
Отрицательно |
|
|
Бактерии дизентерийной группы |
Отрицательно |
|
|
ЭТ, ЭИ, ЭП эшерихии |
Отрицательно |
О дисбактериозе кишечника свидетельствует:
- увеличение количества одного или нескольких видов условно-патогенных микроорганизмов при нормальном количестве бифидобактерий в кишечнике,
- увеличение одного или нескольких видов условно-патогенных микроорганизмов при умеренном снижении количества бифидобактерий (на 1-2 порядка – до 107-108 КОЕ/г),
- снижение содержания представителей облигатной микрофлоры (бифидобактерий и/или лактобацилл) без увеличения количества сапрофитной или условно-патогенной микрофлоры кишечника,
- умеренное или значительное (7 КОЕ/г) снижение количества бифидобактерий в сочетании с выраженным уменьшением количества лактобацилл, появлением изменённых форм кишечной палочки, выявлением одного или нескольких представителей условно-патогенных микроорганизмов в высоких титрах (до 107-108 КОЕ/г).
Что может влиять на результат?
Антибактериальная терапия или терапия пробиотиками.
Также рекомендуется
- Дисбактериоз кишечника с определением чувствительности к антибиотикам
- Копрограмма
- Анализ кала на цисты и вегетативные формы простейших
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
Кто назначает исследование?
Гастроэнтеролог, терапевт, врач общей практики, педиатр.
Литература
- Шульпекова Ю.О. Кишечные бактерии, пробиотики и перспективы их применения для лечения заболеваний желудочно-кишечного тракта / Ю.О. Шульпекова // Фарматека. – 2008. – № 2. – С. 46-51.
- Бабак О.Я. Современная диагностика и лечение нарушений микробиоценоза кишечника / О.Я. Бабак, И.Э. Кушнир // Провизор. – 1999. – № 15-16. – С. 91–99.
- Отраслевой стандарт 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника».
- Минушкин О.Н. Дисбактериоз кишечника: современное состояние проблемы / О.Н. Минушкин // Consilium-medicum. – 2007. – T. 9, № 7. – С. 59-64.